ARTÍCULOS Y PUBLICACIONES
MECANISMOS MOLECULARES DE INFLUENCIA DE CAMPOS DE INFORMACIÓN EN EL CULTIVO DE CÉLULAS DE ENDOMETRIO
S. S. KONOVALOV, Doctor en Medicina, Profesor Catedrático, kvantdnk@yandex.ru
Director del Instituto de Medicina Informativa de la MANEB (Academia Internacional de Ciencias de la Ecología, de la Seguridad del Hombre y de la Naturaleza), San Petersburgo.
S. S. KONOVALOV, Doctor of Medicine, Professor, kvantdnk@yandex.ru
Director of Institute of Information Medicine MANEB, St. Petersburg.
El objetivo del estudio fue analizar el nivel de expresión de las moléculas de señalización en el endometrio normal de las mujeres para evaluar la efectividad de la influencia de los Campos de Información (CI).
Para analizar la expresión de 9 moléculas de señalización (PCNA, Ciclina A, Ciclina E, Caspasa 3, ER, integrina αVβ5, Bcl2, Caspasa 9), se utilizaron cultivos de células endometriales obtenidos por métodos estándar.
El cultivo primario se aisló en placas tratadas con una solución de gelatina (Biolot), seguido de cultivo en botellas de 50 ml tratadas en superficie (JetBiofil, 25 cm2, Biolot). Las células se cultivaron en 5 ml de medio de cultivo por vial y en 3 ml de medio de cultivo por placa de Petri de 3,5 cm de diámetro. El medio de cultivo contenía 15% de suero fetal bovino, 82,5% de DMEM, 1,5% de HEPES, L-glutamina.
Después de 5-7 días, el cultivo primario alcanzó una monocapa y luego se llevó a cabo el procedimiento de resiembra de acuerdo con el siguiente método: el medio de cultivo se retiró de la placa de Petri (vial) usando una pipeta estéril. Para eliminar el medio residual y las células muertas, el lavado se realizó en dos turnos de DPBS sin Ca y Mg, 3 ml por placa de Petri y 5 ml por vial. Para eliminar las células del sustrato, utilizamos una solución de tripsina-verso en una proporción de 1: 3 (Biolot), 500 μl por placa de Petri y 1 ml por vial, durante 2 minutos a 37 ° C. El desprendimiento de células se controló bajo un microscopio. Para bloquear la reacción enzimática, se añadieron 3 ml de medio de cultivo por placa de Petri y 5 ml por vial. Luego, la suspensión celular se centrifugó durante 5 minutos a 1G. Este pasaje se consideró cero. La concentración de inóculo fue de aproximadamente 5 x 103 células por vial de 50 ml.
Todas las culturas se dividieron en 2 grupos: 1er grupo (control) - sin una sesión de efecto informativo energético, 2º grupo - cultivos celulares, a los que se aplicó una sesión de efecto informativo energético. 24 horas después de la exposición, se fijaron las células en la placa. Se realizó un estudio de moléculas de señalización utilizando el método de microscopía láser de inmunofluorescencia homofocal.
Para la reacción de inmunofluorescencia con anticuerpos contra las moléculas de señalización estudiadas, se utilizó un protocolo estándar. La incubación con anticuerpos secundarios conjugados con el fluorocromo Alexa Fluor 647 (1: 1000, Abcam) duró 30 minutos a temperatura ambiente, en la oscuridad. Los núcleos celulares se tiñeron con colorante Hoechst 33258 (Sigma, EE. UU.) (1: 100 a partir de una solución comercial en dH2O) durante 1 minuto (el colorante se usa como un marcador de ADN fluorescente, con lo que se mejora su fluorescencia tras la unión). Las preparaciones terminadas se colocaron bajo cubreobjetos en un medio de montaje fluorescente Dako (Dako, EE. UU.) Y se estudiaron utilizando un microscopio homofocal de inmunofluorescencia láser OLYMPUS FV300.
El estudio morfométrico se llevó a cabo utilizando un sistema de análisis de imágenes microscópicas asistido por computadora que consta de un microscopio Nikon Eclipse E400, una cámara digital Nikon DXM1200, una computadora personal basada en Intel Pentium 4 y software “Videotest - Morfología 5.2.” En cada caso, se analizaron 10 campos de visión con un aumento de x400. El área de expresión de estos marcadores se calculó como la relación del área ocupada por las células inmunopositivas al área total de células en el campo de visión y se expresó como un porcentaje. Para el procesamiento de datos estadísticos, se usó la prueba de Wilcoxon para comparar varias muestras.
La influencia del efecto del campo de información sobre la expresión de la proteína proliferotrópica PCNA.
PCNA, el antígeno nuclear de las células en proliferación, es un factor auxiliar en la reparación de la ADN polimerasa. Las tres moléculas de PCNA forman un trímero anular con un orificio para el ADN bicatenario en la parte central, que es una abrazadera deslizante (sliding clamp) en forma de toro que detiene la ADN polimerasa delta durante la polimerización de la matriz y proporciona una síntesis de ADN altamente eficiente. La determinación de la expresión de esta proteína se utiliza para diagnosticar neoplasias de diversos tejidos del cuerpo, incluido el endometrio [Rudzitis-Auth et al., 2013].
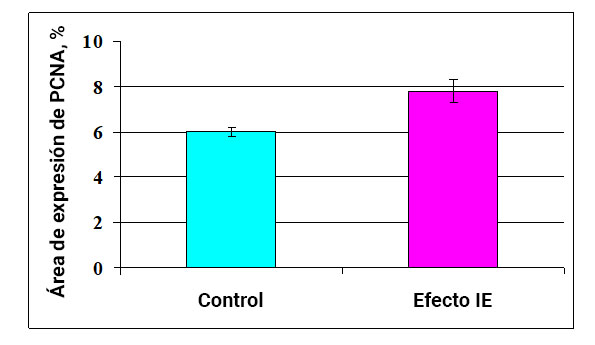
Fig.1. La influencia del efecto del campo de información sobre la capacidad proliferativa de las células endometriales.
* - p <0.05 - comparado con el control.
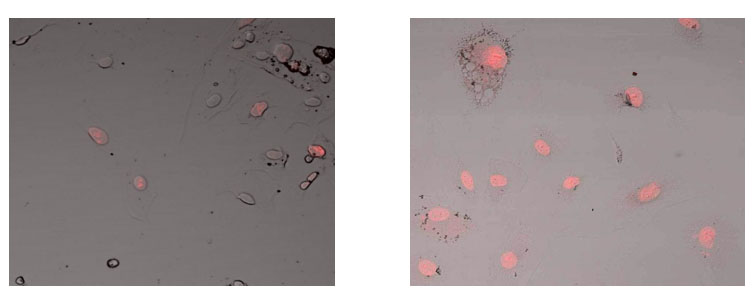
Fig. 2. La influencia del efecto del campo de información sobre la expresión de PCNA en cultivo de células endometriales normales. Microscopía homofocal, aumento 400x: a la izquierda - control, a la derecha - el Efecto Informativo Energético. Fluorescencia Hoechst azul - 33258, roja - anticuerpos contra PCNA + Alexa 647.
En el estudio del cultivo de células endometriales, se encontró que el área de expresión del marcador de proliferación celular de PCNA en el control es 6.01 ± 0.22%. Además, después del Efecto IE, este indicador aumenta en un 30% a 7.82 ± 0.51% (Fig. 1, 2). Por lo tanto, el Efecto IE excita la actividad proliferativa de las células de endometrio normal.
La influencia del efecto del campo de información sobre la expresión de las caspasas
Las caspasas (caspase - cysteine-dependent aspartate specific protease) son una familia de proteasas de cisteína que descomponen las proteínas, en el lugar donde contienen aminoácidos de aspartato. Las caspasas juegan un papel importante en los procesos de apoptosis, necrosis e inflamación. Todas las caspasas se producen inicialmente en una forma inactiva, y se activan según sea necesario por las caspasas iniciadoras cortando un área pequeña. Las caspasas iniciadoras se activan mediante complejos proteicos especiales: apoptosomas, osomas PIDD, DISC.
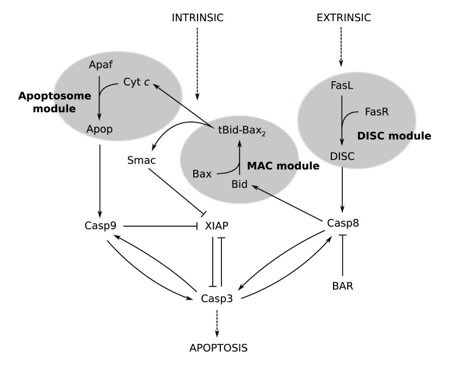
Fig. 3. Interacción de las caspasas en la apoptosis. Flechas - activación, "mordazas" - inhibición. El ensamblaje del apoptosoma conduce a la activación de la caspasa 9 [Harrington et al., 2008].
La caspasa-3, junto con las caspasas 8 y 9, es responsable de los eventos clave en los procesos de apoptosis (Fig. 3). La caspasa-3 amplifica las señales de iniciación de las caspasas 8 y 9 para completar el proceso de apoptosis. La caspasa 9, codificada por el gen CASP9 en el primer cromosoma, juega un papel importante en la cadena de señales de apoptosis, probablemente representando el nodo "superior" de la cascada de proteasa de esta cadena después del ensamblaje del apoptosoma. Después de ser activada por el apoptosoma, la caspasa 9 a su vez activa una serie de otras moléculas, lo que finalmente causa la muerte celular programada.
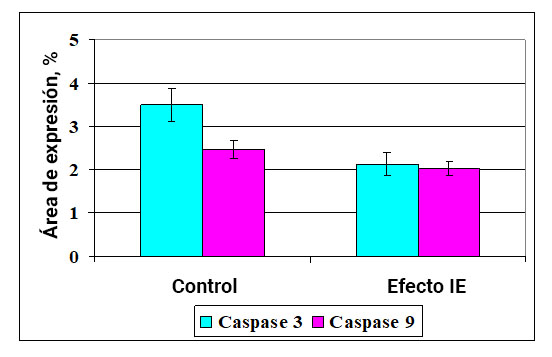
Fig. 3. La influencia del efecto del campo de información sobre la expresión de caspasas en el endometrio.
* - p <0.05 - comparado con el control.
Al estudiar el cultivo de células endometriales, se encontró que el área de expresión de caspasa-3 en el control es de 3.50 ± 0.38%. Además, después de la exposición a IE, este indicador disminuye en un 65% y asciende a 2.12 ± 0.27% (Fig. 4, 5). Además, el área de expresión de caspasa-9 en el control fue de 2.47 ± 0.21%, que no difirió significativamente del valor obtenido después de la exposición a IE, donde este indicador fue de 2.02 ± 0.17%.
Por lo tanto, la exposición a efecto IE reduce la síntesis de caspasa-3, pero no la caspasa-9. Esto permite sugerir que La influencia del efecto IE antiapoptótica está asociada con la inhibición de las vías de apoptosis relacionadas con la molécula FasL (Fig. 3).
1.3. La influencia del efecto del campo de información sobre la expresión de la proteína anti-apoptótica Bcl2
El regulador de la apoptosis Bcl-2 es un factor de proteína intracelular, el principal representante de la familia Bcl-2. Suprime la apoptosis en muchos sistemas celulares, incluidas las células linfohematopoyéticas y neuronales. Regula la muerte celular controlando la permeabilidad de la membrana mitocondrial.
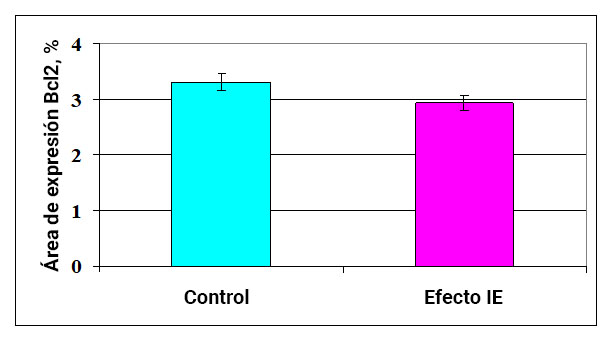
Fig. 4. La influencia del efecto del campo de información sobre la expresión de la proteína antiapoptótica Bcl-2 en el endometrio.
* - p <0.05 - comparado con el control.
Inhibe las caspasas al evitar la liberación de citocromo c de las mitocondrias y / o mediante la unión del factor de activación de la apoptosis APAF1 [Di Pietro et al., 2013].
El estudio del cultivo de células endometriales mostró que el área de expresión de la proteína antiapoptótica Bcl-2 en el control es 3,31 ± 0,15%. Además, después de la exposición a IE, este indicador disminuye en un 13% a 2.94 ± 0.13% (Fig. 6).
Por lo tanto, la exposición al efecto IE, por un lado, reduce el nivel de apoptosis dependiente de caspasa en las células endometriales normales y, por otro lado, reduce ligeramente la síntesis de la proteína antiapoptótica Bcl-2.
Esto probablemente refleja las complejas interacciones de señal inducidas por la exposición al efecto IE y destinadas a mantener la homeostasis celular.
1.4. La influencia del efecto del campo de información sobre la expresión de ciclinas
Cada tipo de ciclinas, marcadas de A a H, tiene una región homóloga (150 residuos de aminoácidos) llamada "caja de ciclina". Este sitio es responsable de la unión a las quinasas dependientes de ciclina (CDK).
En la familia de la ciclina (ciclina A - ciclina J), se conocen 14 proteínas. Algunos miembros de la familia forman subfamilias. Las ciclinas se dividen en dos subfamilias: ciclinas G1 (C, D y E) y ciclinas mitóticas (A y B) [Gezginc et al., 2013].
Las ciclinas son proteínas de intercambio rápido con una vida media corta, que es de 15-20 minutos para las ciclinas de tipo D. Esto asegura el dinamismo de sus complejos con las quinasas dependientes de ciclina. Para la degradación intracelular de las ciclinas, es responsable la secuencia N-terminal de los residuos de aminoácidos, llamada caja de destrucción (destruction box).
Cuando las células pasan por el ciclo celular después de la activación de varias CDK, se desactivan según sea necesario. En el último caso, tiene lugar la degradación proteolítica de la ciclina, que está en complejo con CDK.
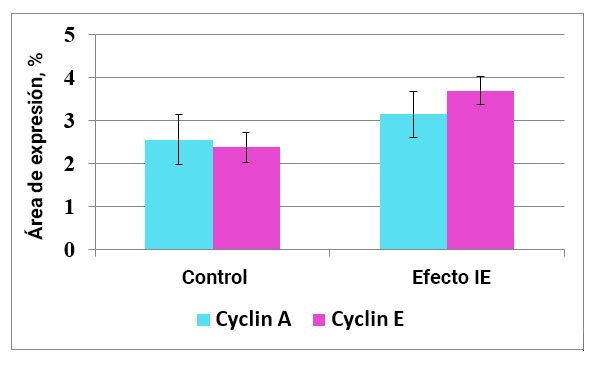
Fig. 5. La influencia del efecto del campo de información sobre la expresión de ciclinas en el endometrio.
* - p <0.05 - comparado con el control.
Al estudiar el cultivo de células endometriales, se encontró que el área de expresión de ciclina A en el control es de 2.55 ± 0.58%. Además, después de la exposición al IE, este indicador aumentó en un 23% y ascendió a 3.14 ± 0.54% (Fig. 7, 8).
Para la segunda prueba de ciclina, se observó la misma tendencia. El área de expresión de la ciclina E en el control fue de 2.37 ± 0.35%, y bajo la influencia de la exposición a IE, este indicador aumentó en un 56% y ascendió a 3.69 ± 0.32% (Fig. 7, 8).
Por lo tanto, la influencia del campo de información tiene un efecto regulador sobre el paso de la fase G1 del ciclo celular por la célula y su entrada en la mitosis.
1.5 La influencia del efecto del campo de información sobre la expresión de los receptores de estrógenos.
Los estrógenos afectan la diferenciación de varios tejidos de todo el cuerpo. El sitio principal de la síntesis de estrógenos son los ovarios y el cuerpo lúteo, y también se ha comprobado la formación de estas hormonas en las glándulas suprarrenales, los testículos y la placenta. Actualmente, se han descubierto dos tipos de receptores de estrógenos (ER) en tejidos de mamíferos: ER-α y ER-β.
Se expresan en muchos tejidos de los órganos humanos: ER-α: en la glándula pituitaria anterior, útero, vagina, testículos, hígado, riñones, ER-β: principalmente en la glándula tiroides, folículos ováricos en crecimiento, piel, próstata, cartílago, huesos, orina. vejiga, pulmones, tracto gastrointestinal.
Los receptores de estrógenos determinan la sensibilidad del endometrio a esta hormona y median su efecto en la célula. A su vez, el nivel de estos receptores está sujeto a un control hormonal complejo y puede variar en diversas situaciones fisiológicas y patológicas.
El cambio en el contenido de los receptores de estrógenos durante el ciclo se asocia principalmente con un cambio en la concentración de estrógenos en el plasma sanguíneo.
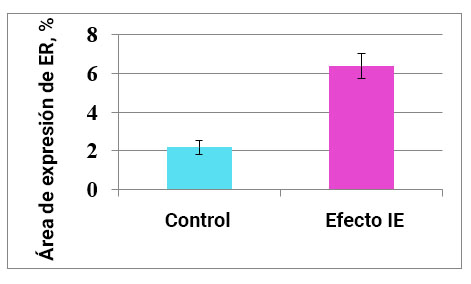
Fig. 6. La influencia del efecto del campo de información sobre la expresión de los receptores de estrógenos en el endometrio.
* - p <0.05 - comparado con el control.
Al estudiar el cultivo de células endometriales, se encontró que el área de expresión de los receptores de estrógenos en el control es de 2.18 ± 0.38%. En este caso, después de la exposición a IE, este indicador aumenta 3 veces a 6.36 ± 0.65% (Fig. 9, 10). Por lo tanto, la exposición al efecto IE aumenta la actividad hormonal de las células endometriales normales.
Este resultado es de gran importancia práctica. Se sabe que en mujeres con endometritis crónica que tienen antecedentes de infecciones de transmisión sexual, enfermedades inflamatorias del sistema reproductivo e infecciones mixtas, se observa una disminución significativa en la expresión del receptor de estrógenos en la fase temprana de la secreción [Mishra et al., 2008].
Cabe señalar que las desviaciones más pronunciadas de los indicadores normales de expresión endometrial a hormonas esteroides en estos pacientes son características de las células del epitelio glandular de la capa funcional.
Dado que la endometritis crónica es una de las principales causas de infertilidad en las mujeres, el tratamiento de esta patología es de gran importancia sociodemográfica.
Con base en los datos obtenidos sobre la capacidad del campo de Información para aumentar la expresión de los receptores de estrógenos, se puede suponer que la exposición al efecto del campo de información es un método prometedor de terapia de infertilidad.
1.6. La influencia del efecto del campo de información sobre la expresión de las integrinas.
Las integrinas son receptores de células de superficie que interactúan con la matriz extracelular y transmiten varias señales intercelulares. De ellas depende la forma de la célula, su movilidad, ellas participan en la regulación del ciclo celular.
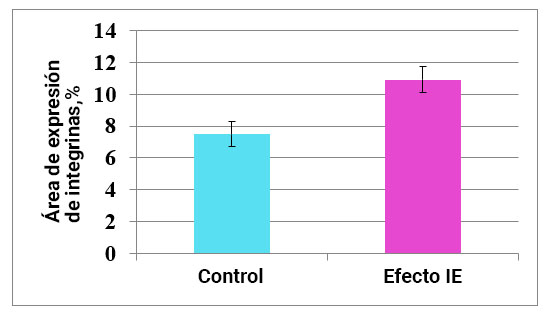
Fig. 7. La influencia del efecto del campo de información sobre la expresión de los receptores de estrógenos en el endometrio.
* - p <0.05 - comparado con el control.
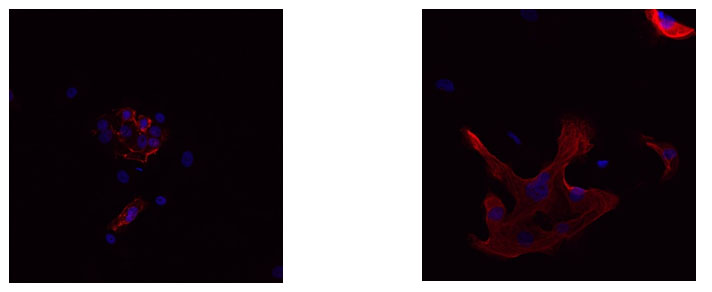
Fig. 8. La influencia del efecto del campo de información sobre la expresión de los receptores de estrógenos en el cultivo de células endometriales normales. Microscopia homofocal, aumento 400x: A - control, B - efecto informativo energético. Fluorescencia Hoechst azul - 33258, rojo - anticuerpos contra αVβ5integrina + Alexa 488.
Estructuralmente, los receptores de integrina son heterodímeros obligados: cada uno consta de una subunidad alfa y una subunidad beta. La integrina beta-5 (β5) es una proteína de membrana, un producto del gen ITGB5, la subunidad beta de la integrina αVβ5, es un receptor de vitronectina y, en menor medida, de fibronectina.
Al estudiar el cultivo de células endometriales, se encontró que el área de expresión de la integrina αVβ5 en el control es de 7.5 ± 0.76%. Además, después de la exposición a IE, este indicador aumenta en un 45% a 10.9 ± 0.81% (Fig. 9, 10).
Por lo tanto, la exposición al campo de información activa la expresión de integrina αVβ5 en células endometriales normales. La importancia práctica de este resultado radica en el papel principal de la integrina αVβ5 en el proceso de implantación de óvulos y embarazo.
Se sabe que un embrión de preimplantación humano expresa en su superficie un conjunto completo de subunidades de integrina: α3, αv, β1, β3, β4, β5, que cambia durante la fragmentación. Al comienzo de la implantación, se detectan α3 β1, α3 (o α6) β4, αv β3 y αv β5 en la superficie del trofoblasto.
Las siguientes subunidades de integrina se determinan constantemente en la superficie del epitelio uterino: α2, α3, α6, β1, β4, β5 [Bloor et al., 2002]. La apariencia de las subunidades restantes se regula durante el ciclo: en la superficie del epitelio glandular, αv, α1, α9 aumentan después de la ovulación, pero α1 disminuye en la fase secretora tardía. β3 en la superficie del epitelio glandular aparece el día 19 del ciclo, y β6 - durante la fase secretora.
Por lo tanto, en el momento de la implantación en la superficie del epitelio, se determinan α2 β1, α3 β1, α9 β1, α6 β4, αv β3, αv β5, αv β6. α6 β4 está presente en la superficie basal de las células epiteliales, y α2 β1 y α3 β1 están en el lateral, y αv β5 está en la apical.
Posteriormente, el trofoblasto extiende las células epiteliales y entra en contacto con la membrana basal. En este momento, se forman los sistemas de enzimas trofoblasto y comienza la invasión, durante la cual se produce la interacción con los elementos de la matriz intercelular. Entonces, al llegar a la membrana basal del epitelio uterino, el trofoblasto expresa integrinas α6β4, que lo fijan en la laminina de la membrana basal e inducen la secreción de enzimas que lo destruyen.
Después de esto, se logra el contacto con el estroma del endometrio; al mismo tiempo, se expresan otras integrinas (principalmente αvβ3, αvβ5), que fijan el trofoblasto ya en el estroma endometrial en proteínas de osteopontina, trombospondina, etc., e inducen la secreción de otras enzimas que destruyen el estroma del tejido conectivo, etc., proporcionando una mayor penetración en el endometrio [Lessey, 2002].
Por lo tanto, la integrina αvβ5 es la que asegura la implantación del huevo y el embarazo. Usando la influencia del efecto del campo de información en mujeres con infertilidad y aborto espontáneo crónico, es posible esperar la activación de la síntesis de esta molécula de señalización y, como resultado, el embarazo.
CONCLUSION
Resumiendo los datos obtenidos relativos a la influencia del efecto del campo de información sobre el endometrio humano normal, se puede resumir que dicho efecto contribuirá a la normalización de la actividad funcional del endometrio y será eficaz en el tratamiento y prevención de la infertilidad y el aborto espontáneo crónico.
La actividad biológica del campo de información se basa en su capacidad para activar la expresión de receptores de estrógenos, promover el embarazo al aumentar la síntesis de moléculas de adhesión (integrina αvβ5) y estimular los procesos de renovación celular (aumentando la expresión de PCNA, ciclinas, reduciendo la síntesis de la caspasa-3).
Referencias bibliográficas:
- Harrington H.A., Ho K.L., Ghosh S., Tung K.C. Construction and analysis of a modular model of caspase activation in apoptosis (Construcción y análisis de un modelo modular de activación de caspasas en apoptosis). // Theor Biol Med Model. – 2008. – Vol. 124. – P. 1453-1459.
- Bloor D.J., Metcalfe A.D., Rutherford A. Expression of cell adhesion molecules during human preimplantation embryo development (Expresión de moléculas de adhesión celular durante el desarrollo embrionario de preimplantación humana). // Mol.Hum.Reprod.- 2002. - Vol.8, N3. – P. 237-245.
- Lessey B.A. Adhesion molecules and implantation (Moléculas de adhesión e implantación). // J.Reprod.Immunol. – 2002. – Vol. 55, N 1-2. – P. 101-112.
- Rudzitis-Auth J., Menger M.D., Laschke M.W. Resveratrol is a potent inhibitor of vascularization and cell proliferation in experimental endometriosis (El resveratrol es un potente inhibidor de la vascularización y la proliferación celular en la endometriosis experimental.) // Hum Reprod. – 2013. – Vol. 28, N 5. – P. 1339-1347.
- Di Pietro C., Cicinelli E., Guglielmino M.R., Ragusa M., Farina M., Palumbo M.A., Cianci A. Altered transcriptional regulation of cytokines, growth factors, and apoptotic proteins in the endometrium of infertile women with chronic endometritis (Regulación transcripcional alterada de citocinas, factores de crecimiento y proteínas apoptóticas en el endometrio de mujeres infértiles con endometritis crónica). // Am J Reprod Immunol. – 2013. – Vol. 69, N 5. – P. 509-517.
- Gezginc S.T., Celik C., Dogan N.U., Toy H., Tazegul A., Colakoglu M.C. Expression of cyclin A, cyclin E and p27 in normal, hyperplastic and frankly malignant endometrial samples (Expresión de ciclina A, ciclina E y p27 en muestras endometriales normales, hiperplásicas y francamente malignas). // J Obstet Gynaecol. – 2013. – Vol. 33, N 5. – P. 508-511.
- 7. Mishra K., Wadhwa N., Guleria K., Agarwal S. ER, PR and Ki-67 expression status in granulomatous and chronic non-specific endometritis (Estado de expresión de ER, PR y Ki-67 en endometritis inespecífica granulomatosa y crónica). // J Obstet Gynaecol Res. – 2008. – Vol. 34,
N 3. – P. 371-378.
